Catégorie : Ophtalmologie
Les bases anatomiques du cristallin et Présentation clinique
Les bases anatomiques du cristallin et Présentation clinique
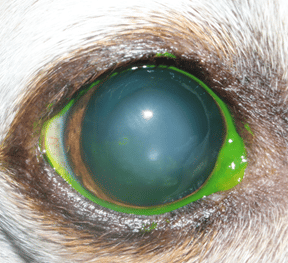
Le cristallin est une lentille transparente située à l’intérieur de l’œil permettant la réfraction des rayons lumineux pour une mise au point sur la rétine. Si l’on compare l’œil à un appareil photographique, le cristallin serait en quelque sorte la lentille de l’objectif. Le cristallin n’est ni vascularisé, ni innervé et les échanges se font par diffusion. Malgré cette apparente simplicité, la structure et la physiologique sont complexes.
Le cristallin est proportionnellement plus grand chez les animaux domestiques que chez l’homme. Le cristallin du chien a ainsi un volume d’environ 0,5mL et en moyenne une épaisseur de 7mm pour un diamètre équatorial de 10mm.
Le cristallin a la forme d’une lentille biconvexe aplatie d’avant en arrière, il présente une face antérieure et une face postérieure qui sont reliées par un équateur, et chacune de ces faces est centrée sur un pôle.
Le cristallin est constitué de plusieurs éléments :
L’ensemble de ces trois structures forme le cristallin qui est soutenu par un autre élément anatomique, la zonule de Zinn.
Principales constantes chimiques du cristallin :
Le cristallin est relativement pauvre en eau (65 %) ce qui lui confère un indice de réfraction élevé par rapport au milieu aqueux où il baigne. Cette teneur en eau diminue avec l’âge, et cela du cortex vers le noyau.
Par opposition, le taux en protéines du cristallin est très élevé (35%). Les protéines cristalliniennes peuvent être divisées en protéines solubles ou cristallines (85%) et protéines insolubles ou albuminoïdes (15%). Les protéines insolubles sont principalement associées aux membranes des fibres cristalliniennes tandis les protéines solubles sont considérées comme les protéines structurelles des fibres cristalliniennes.
La déshydratation relative du cristallin est permise par un transport actif de cations au niveau de l’épithélium antérieur par l’action d’une pompe –
-ATPase. Le cristallin maintient une concentration élevée de potassium et basse de sodium et de chlorure par rapport à l’humeur aqueuse. La sortie d’eau du cristallin est passive et résulte du transport actif des cations.
Nutrition du cristallin :
Le cristallin est un tissu exclusivement épithélial et de ce fait avasculaire. L’apport continu de glucose, d’oxygène et de différents nutriments par l’humeur aqueuse permet au cristallin avasculaire de produire l’énergie (sous forme d’ATP) nécessaire au mécanisme de transport actif et à la synthèse protéique. L’essentiel de la consommation énergétique a lieu dans l’épithélium, site de tous les transports actifs. Le métabolisme du glucose se fait en grande partie par l’intermédiaire de la glycolyse anaérobie avec production d’acide lactique. Cette voie est contrôlée par une enzyme nommée hexokinase.
Les autres voies minoritaires du métabolisme du glucose par le cristallin sont les voies des pentoses phosphates et du sorbitol.
Cas de la cataracte diabétique : En cas de concentration en glucose élevé, l’hexokinase est inhibée. Ce mécanisme prévient la formation d’acide lactique en trop grande quantité (diminution du pH et activation de protéases cristalliniennes). L’enzyme aldose réductase est ainsi activée en tant que voie métabolique alternative. Cette activation aboutit à l’accumulation de sorbitol dans les cellules cristalliniennes. L’augmentation de la pression osmotique suite à l’excès de sorbitol provoquera une cataracte par inhibition des fibres cristalliniennes.
Modifications liées à l’âge:
Une augmentation progressive de la densité de la portion centrale du cristallin ou sclérose cristallinienne est observée chez les animaux âgés. Chez le chien, ce changement devient visible à partir de 5-6 ans. Ces modifications sont cependant plus précoces chez les chiens de grande race à longévité courte que sur les chiens de petites races.
Cette observation est le reflet clinique de plusieurs modifications moléculaires :
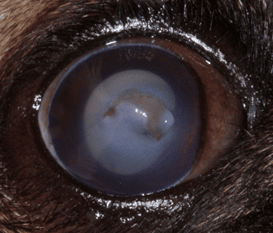
Ce changement n’a initialement pas d’impact sur la vision et l’examen du fond d’œil. La sclérose du cristallin se manifeste par un aspect voilé et bleuté du noyau du cristallin sans opacification. Cependant ce mécanisme physiologique se complique de cataractes lentement évolutives vers l’âge de 10 ans qui peuvent induire une perte de vision.

La cataracte correspond à l’opacification du cristallin et reste le dénominateur commun à de nombreuses affections du cristallin mais aussi de nombreuses affections intraoculaires et systémiques.
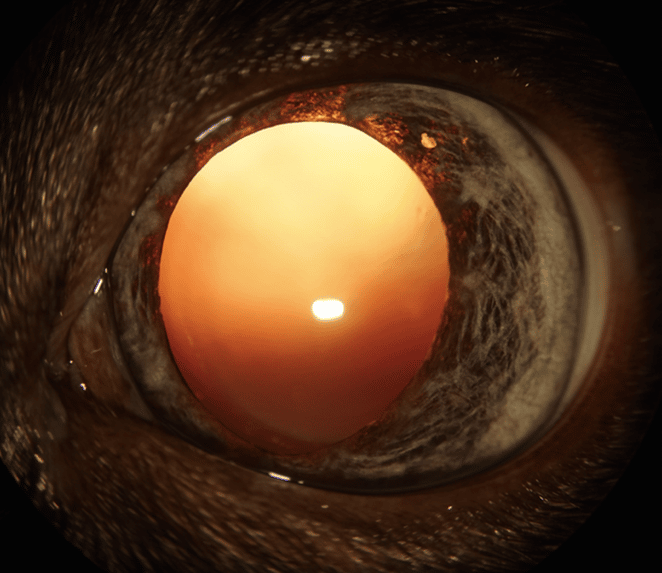
Cristallin sans anomalie | 
Cataracte immature |
Pathogénie moléculaire/cellulaire des cataractes
Les modifications exactes responsables de la formation d’une cataracte chez les animaux domestiques restent incertaines, à l’exception de celles associées aux cataractes diabétiques.
On suppose que des modifications de la teneur en protéines du cristallin, de la fonction métabolique de l’épithélium cristallinien et de la concentration ionique puissent être responsable de la dégradation des membranes cellulaires des fibres cristalliniennes, aboutissant à une perte de transparence liée à la rupture de ces fibres.
Examen clinique :
L’examen du cristallin doit être réalisé après dilatation pupillaire (Tropicamide 0,5% ou 1% toutes les 5min pendant 15min) à l’aide d’un biomicroscope.
La description la plus précise possible de la localisation et de la taille des opacités est primordiale pour formuler des hypothèses concernant l’origine des opacités mais également pour le suivi clinique.
Topographie des opacités :

Cataracte incipiente | 
Cataracte immature |

Cataracte mature | 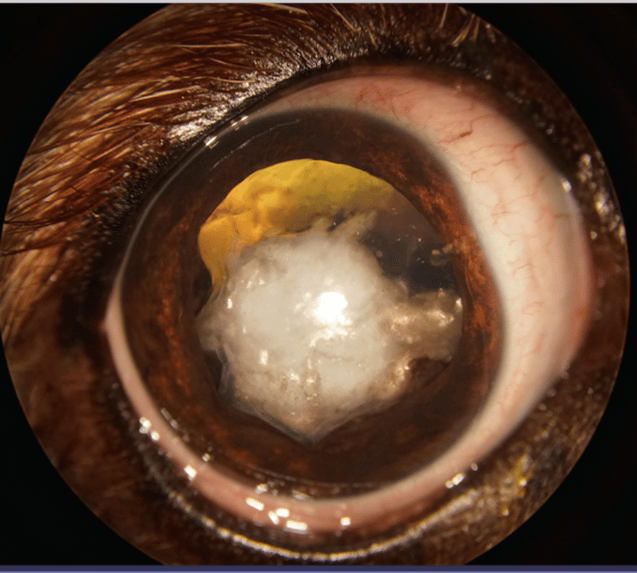
Cataracte hypermature |
Signes cliniques évocateurs :
Potentiel évolutif des opacités :
Uvéite associée aux cataractes :
Les uvéites phaco‐induites sont un groupe de réponse inflammatoire faisant suite à la libération des protéines cristalliniennes.
Ce groupe comprend au moins deux manifestations cliniques différentes : l’uvéite phacolytique associée à une fuite de fragments protéiques au travers d’une capsule intacte et l’uvéite phacoclastique associée à la libération de protéines au travers d’une rupture capsulaire.
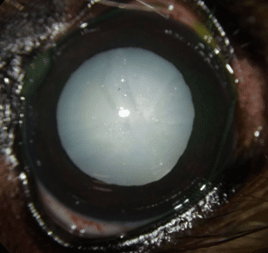
Causes des cataractes
Etudes épidémiologiques menées à l’ENVA :
Chez le chien, les principales causes de cataracte sont supposée héréditaire (28%), sénile (23%), secondaire à une atrophie progressive de la rétine (12%), congénitale (5%), diabétique (5%), traumatique (4%), secondaire à une uvéite (3%) et hypocalcémique (0,3%) (Donzel et al. Veterinary Ophthamology 2017)
Chez le chat, les principales causes de cataracte sont secondaire à une uvéite (36%), congénitale (16%), sénile (11%), supposée héréditaire (8%), traumatique (8%), secondaire à une luxation du cristallin (3%), secondaire à un glaucome (2%) et diabétique (0,2%) (Guyonnet et al. Veterinary Ophthalmology 2019)
Cataracte congénitale : On considère comme congénitale une opacité cristallinienne mise en évidence avant l’âge de 8 semaines et/ou associée à une autre congénitale (microphtalmie, persistance de membrane pupillaire, microphakie, persistance de l’artère hyaloïde ou du vitré primitif). Ces cataractes peuvent être d’origine héréditaire ou secondaire à l’exposition à un agent tératogène ou infectieux pendant la gestation.
Face à l’impossibilité de certifier l’occurrence d’une anomalie pendant la gestation, les cataractes congénitales sont supposées d’origine héréditaire par le European College of Veterinary Ophthalmologists (ECVO) et l’animal atteint ne doit pas être utilisé pour la reproduction.

Cataracte sénile : L’âge seuil d’apparition de ces opacités est relativement arbitraire et dépend de la race chez le chien.
On considère comme sénile une opacité cristallinienne mise en évidence chez un chien de grande race de plus de 6 ans, un chien de petite race de plus de 10 ans et un chat de plus de 13 ans. L’aspect clinique des cataractes séniles et leur développement est très variable mais elles se manifestent la plupart du temps par une sclérose nucléaire marquée associée à des opacités multifocales ponctuées à linéaires dans le noyau adulte et/ou des opacités corticales cunéiformes.
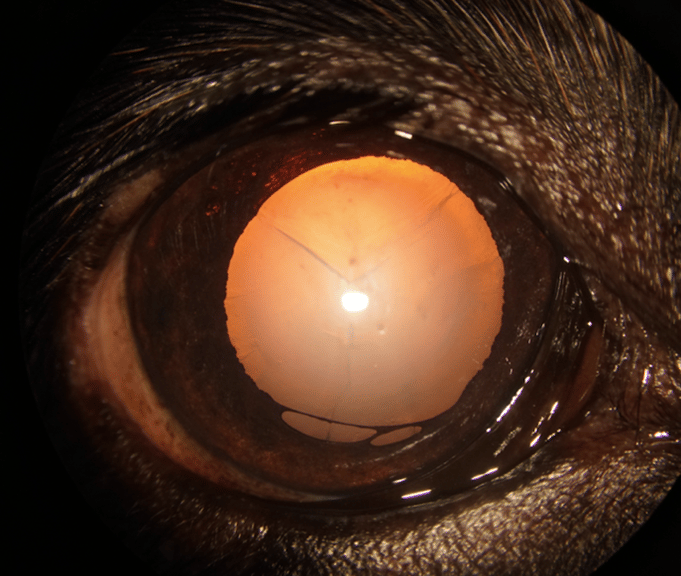
Cataracte supposée héréditaire: L’European College of Veterinary Ophthalmologists (ECVO) conseille de ne pas faire reproduire l’animal atteint.
Chez le chien : Il s’agit de la principale cause de cataracte dans cette espèce (Donzel et al. Veterinary Ophthamology 2017). L’atteinte est le plus souvent bilatérale sans autre anomalie oculaire associée et les animaux atteintes sont typiquement des individus de pure race d’âge jeune à moyen. La nature héréditaire de la transmission de ces opacités n’a été démontrée que dans peu de races canines mais est suspecté dans près de 160 races.
Une transmission simple autosomale récessive semble le mode de transmission le plus courant et a été démontrée chez le Staffordshire Bull Terrier, le Boston Terrier (Cataracte juvénile) et le Berger Australien (Mellersh et al. Veterinary Ophthalmology 2006, 2009, Journal of Heredity 2007).

Chez le chat : A l’heure actuelle, le caractère héréditaire d’une cataracte n’a été démontrée dans aucune race de chat. Cependant la description de cataractes incipientes supposées héréditaires a été faite dans des populations de chat de race Bengale et de chat Bleu Russe (Bourguet et al. Veterinary Ophthalmology 2017, Nygren et al. Journal of Feline Medecine and Surgery 2018).
Ces opacités sont principalement observées chez de très jeunes animaux et un développement pendant la gestation est donc fortement suspecté.
Par analogie, la majorité des cataractes héréditaires sont congénitales chez l’homme.
Cataractes secondaires :
‐ Maladies métaboliques (Diabète sucré, Hypocalcémie)
‐ Carences alimentaires (Lait maternisé non adapté à l’espèce)
‐ Traumatisme (Perforant, Contendant)
‐ Uvéite, Luxation du cristallin, Glaucome
‐ Parasitaires (E.cuniculi chez LP, CT, CN)
‐ Toxique (Atrophie progressive de la rétine, Irradiation, Médicamenteuse)
Cataracte secondaire au diabète sucré : Le chien est particulièrement sensible au développement d’une cataracte diabétique. Ceci est probablement lié à l’activité élevée de l’enzyme aldose réductase dans cette espèce. La faible incidence de la cataracte diabétique chez le chat a été lié à l’activité beaucoup plus basse de cette enzyme chez les individus > 7 ans (Richter et al. American Journal of Veterinary Research 2002). Dans l’espèce canine, les opacités cristalliniennes peuvent être rapidement évolutives (environ 13% de cas) et s’accompagnent d’une intumescence du cristallin, prédisposant ces animaux au développement de rupture capsulaire le plus souvent équatoriale.
Dans une étude sur l’incidence de la cataracte diabétique chez 200 chiens, 50% des chiens étaient atteints 6 mois après le diagnostic de diabète et 75% 1 an après le diagnostic (Beam et al. Veterinary Ophthalmology 1999).
Cataracte traumatique : Les contusions du cristallin lors de traumatisme contondant peuvent induire la formation d’opacités sous‐capsulaires de degré variable, généralement en regard du site du traumatisme. Ces lésions sont considérées comme secondaires à des dommages par contrecoup aux cellules épithéliales ou à la rupture de fibres cristalliniennes.
Les traumatismes perforants avec perforation de la capsule antérieure du cristallin causent invariablement la formation d’une cataracte focale à diffuse.
Cataracte secondaire aux uvéites chez le chat :
Il s’agit de la principale cause de cataractes chez le chat (Guyonnet et al. Veterinary Ophthamology 2019).
Le cristallin n’étant pas vascularisé, son métabolisme dépend en majorité de l’humeur aqueuse. Les modifications de la composition de l’humeur aqueuse induite par une uvéite sont responsables d’anomalies graves du métabolisme du cristallin et de l’induction d’une cataracte.
Lors d’uvéite antérieure, les premières opacités sont typiquement en position sous capsulaire antérieure axiale et ont un fort potentiel évolutif.
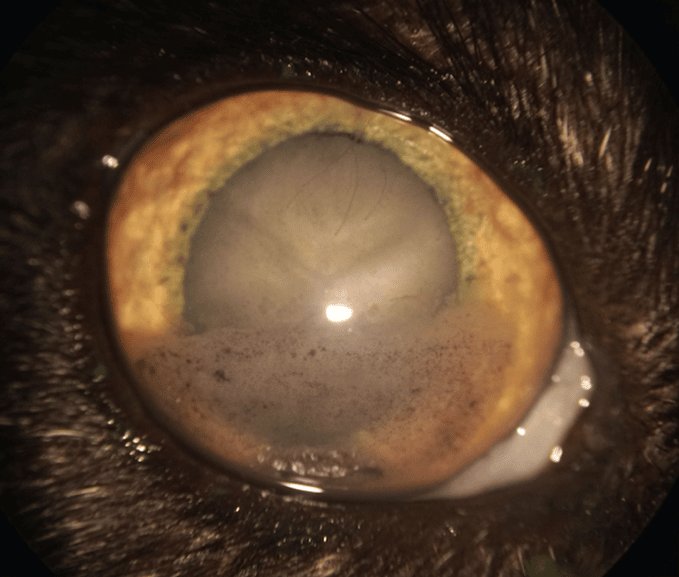
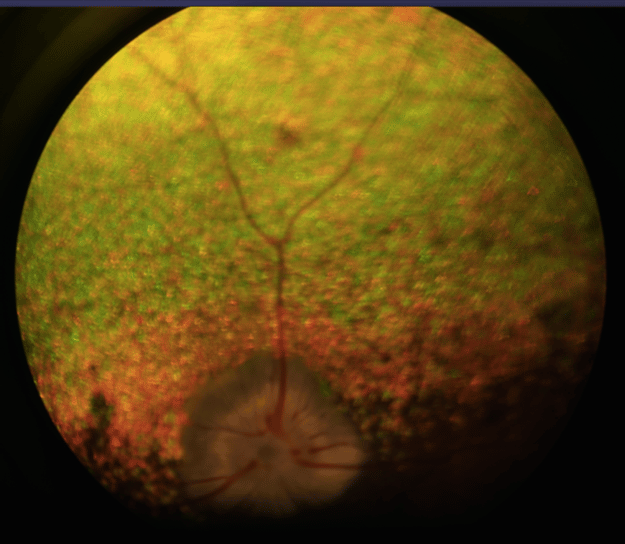
Cataracte toxique secondaire à l’atrophie progressive de la rétine :
La pathogénie de cette lésion n’est pas précisément comprise mais il est supposé que des substances toxiques (dialdehydes hydrosolubles) issues de la dégénérescence des photorécepteurs pourraient diffuser à travers le vitré et seraient toxiques pour les membranes cellulaires des fibres cristalliniennes.
Dans les premiers stades, ces cataractes se manifestent typiquement par la formation de vacuoles équatoriales et corticales postérieures.
Ces opacités sont le plus souvent évolutives pour aboutir à une cataracte complète.
Certaines races, comme le Labrador Retriever, le Caniche et le Cocker Anglais, sont particulièrement touchées par ces cataractes secondaires. Etant donné que les races à risque d’atrophie progressive de la rétine ont également une incidence élevée de cataracte héréditaire, il est possible que chez certains chiens les deux affections ne soient pas liées. II n’existe aucune description de cette complication dans les atrophies rétiniennes félines.
| 
|