
Par le Dr Zélie Robert-Gautier, intern au CHVAtlantia – promotion 2020-21
Qu’est-ce qu’une gastrite chronique ?
La gastrite chronique est une inflammation chronique de l’estomac. Elle peut être liée à une inflammation entretenue par une réaction à médiation immune. Cette affection est retrouvée aussi bien chez le chat que chez le chien.
Ces réactions inflammatoires chroniques sont souvent d’origine polyfactorielle voire même idiopathique (c’est-à-dire dont l’origine est inconnue). Parmi les causes, on suspecte une stimulation immunitaire (antigénique) chronique qui peut être associée à des facteurs bactériens, parasitaires, alimentaires ou intrinsèques. Ainsi, selon les cas, l’animal peut soit présenter une réponse immunitaire normale à des agents pathogènes ou des stimulations antigéniques, soit une réponse anormalement exagérée et inappropriée à des constituants normaux et habituellement non stimulants de l’organisme (hypersensibilité…).
Les symptômes sont le plus souvent digestifs et se manifestent par des vomissements chroniques et des troubles de l’alimentation (dysorexie). Des vomissements hémorragiques (hématémèse) ou des selles noires (méléna) sont parfois observés, témoignant d’un saignement digestif. En cas d’entérite associée, l’animal peut également présenter de la diarrhée et un amaigrissement.
Races prédisposées : lhassa apso, Shih-tzu, caniche nain, berger allemand, basenji, etc.
Comment se fait le diagnostic ?
Echographie abdominale : Cet examen permet de mettre en évidence des images compatibles avec une possible gastrite chronique : paroi gastrique épaissie, signes d’ulcère, inflammation de la graisse en périphérie de l’estomac, etc …
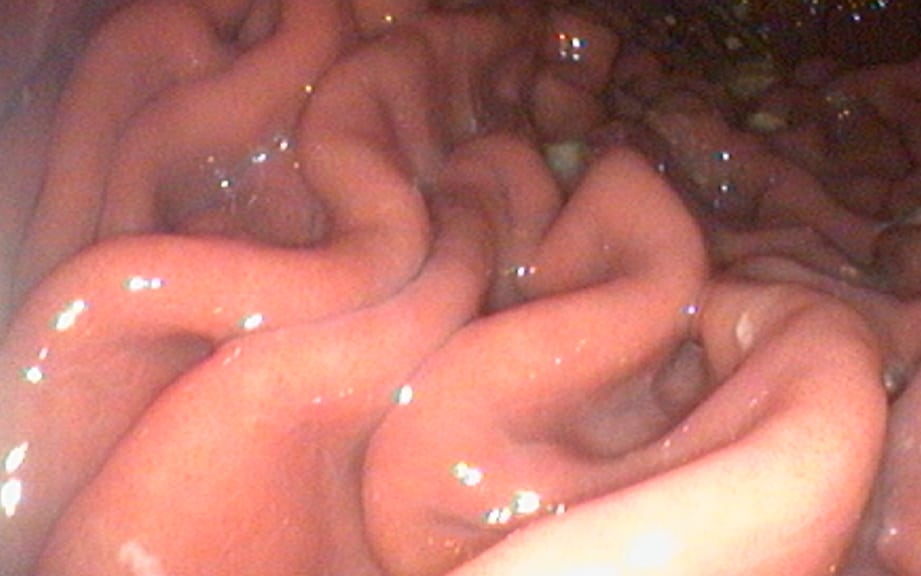
Endoscopie digestive haute : C’est l’examen de choix dans le diagnostic des gastrites chroniques. Il permet de confirmer l’inflammation gastrique, caractérisée par une hyperhémie et un œdème de la muqueuse gastrique, parfois un contenu digestif signant un retard à la vidange gastrique, des ulcères gastriques, etc. L’examen permet également la réalisation systématique de biopsies de la muqueuse gastrique : ce sont ces prélèvements qui, une fois analysés histologiquement, conduiront au diagnostic de gastrite chronique et à l’identification de la cause.
Quel est le traitement ?
Le traitement de la gastrite chronique est multimodal et allie un traitement de fond et un traitement lors de crises. Ce traitement est parfois long.
Traitements de fond : Tout d’abord, un aliment spécifique (hypoallergénique ou hyperdigestible) est recommandé pour faciliter la digestion. Il sera intégré progressivement par une transition alimentaire afin de ne pas aggraver la situation digestive. Par ailleurs, il convient de maîtriser l’acidité gastrique avec des anti-sécrétoires gastriques (ex : oméprazole). Des probiotiques sont également recommandés afin de favoriser le bon fonctionnement de la flore digestive.
En cas de crise : un anti-vomitif (cérénia) associé à un pansement gastrique (phosphaluvet, ulcar…) par voie orale sont recommandés, entre autres traitements.
Si les symptômes persistent, un traitement immunosuppresseur peut s’avérer nécessaire, avec en premier lieu, une corticothérapie. La dose minimale efficace adaptée à l’animal est alors recherchée. Ceci va permettre de lutter contre la composante immunitaire des gastrites chroniques.
Si une origine ou un facteur favorisant a été mis en évidence, un traitement étiologique est nécessaire : antibiotiques, antiulcéreux …
Quel est le pronostic et comment se déroule le suivi ?
Un contrôle clinique est à réaliser à la maison. En cas de rechute ou de persistance des symptômes, un rendez-vous chez le vétérinaire est conseillé afin de réadapter le traitement. Parfois, des biopsies de contrôles peuvent être nécessaires.
Le pronostic et la fréquence des crises aiguës sont variables selon la cause sous-jacente et la réponse au traitement.
par le Dr Morgane Debuigne
1. Epidémiologie
De nombreux cas de corps étrangers végétaux inhalés sont rapportés dans la littérature chez le chien [1]. Certains corps étrangers restent dans l’arbre respiratoire, tandis que d’autres migrent à travers le parenchyme pulmonaire, causant des consolidations pulmonaires, des pneumothorax ou pyothorax, voire migrent dans l’espace rétro-péritonéal [1, 5, 7].
Les signes cliniques associés à cette affection correspondent dans la majorité des cas à une toux d’apparition aigüe suite à une activité en extérieur, productive ou non, associée parfois à des crépitements ou des sifflements respiratoires. Une hyperthermie, un abattement ou une anorexie sont parfois rapportés [5, 7]. Cette affection atteint plus particulièrement les chiens de chasse, avec une majorité de Labradors Retrievers et de Springer Spaniels [3, 4, 5]. Les mâles y sont prédisposés (de même que chez les humains) [1, 3].
2. Localisation des corps étrangers bronchiques
La localisation des corps étrangers végétaux inhalés est variable et n’est pas prévisible pour un animal donné. Les études mentionnent une localisation préférentielle dans le poumon droit en raison d’une angulation plus marquée entre la carina et la bronche souche gauche, que celle entre la carina et la bronche souche droite (Figure 8) [1, 3, 6, 7]. Une étude rétrospective mentionne une répartition à 76% dans le poumon droit, à 46% dans une autre étude [1, 3]. Lorsque le corps étranger se situe dans l’hémithorax gauche, il semble plus souvent localisé dans la partie caudale du lobe cranial gauche [1].
3. Pertinence et fiabilité des examens complémentaires
– Analyses sanguines
Les analyses sanguines révèlent souvent une neutrophilie discrète à modérée, parfois une anémie modérée normocytaire normochrome [1, 7]. La neutropénie observée chez le chien de notre cas n’était toutefois pas surprenante, reflétant une mobilisation des leucocytes sur le site inflammatoire. L’évaluation de la lactatémie avait un intérêt pré-anesthésique (recherche d’une hypoxie tissulaire par hypoventilation), et des gaz du sang artériels auraient également été réalisés si la lactatémie ou la clinique l’indiquaient, afin d’évaluer la ventilation et les échanges pulmonaires (encadré 1).
Les gaz du sang artériels doivent être réalisés en période péri-anesthésique en cas d’éventuelle hypoventilation (complication à rechercher sur un corps étranger bronchique), mais sont coûteux, assez peu accessibles en pratique et nécessitent un prélèvement de sang artériel. La lactatémie en revanche, bien que bien nettement moins spécifique, est un moyen simple et très accessible de mettre en évidence une hypoxie, qui pourrait être secondaire à une hypoventilation sévère.
– Radiographies thoraciques
Les radiographies thoraciques peuvent montrer des opacifications interstitielles à alvéolaires focales, un pneumothorax, un épanchement pleural et/ou un épaississement pleural [3, 4, 5, 7]. Elles permettent rarement d’identifier la présence d’un corps étranger (qui présente souvent une radio-opacité tissulaire), ni sa localisation [4, 5]. Il s’avère qu’un tiers des radiographies évaluées sur des corps étrangers bronchiques sont considérées comme normales ou présentent des infiltrats diffus [3]. Dans 14% des cas où les signes radiographiques sont typiques d’un corps étranger, l’évaluation de sa localisation est incorrecte [3]. C’est l’exploration par bronchoscopie, ou d’autres examens complémentaires tels que le scanner, qui permettent de caractériser l’affection.
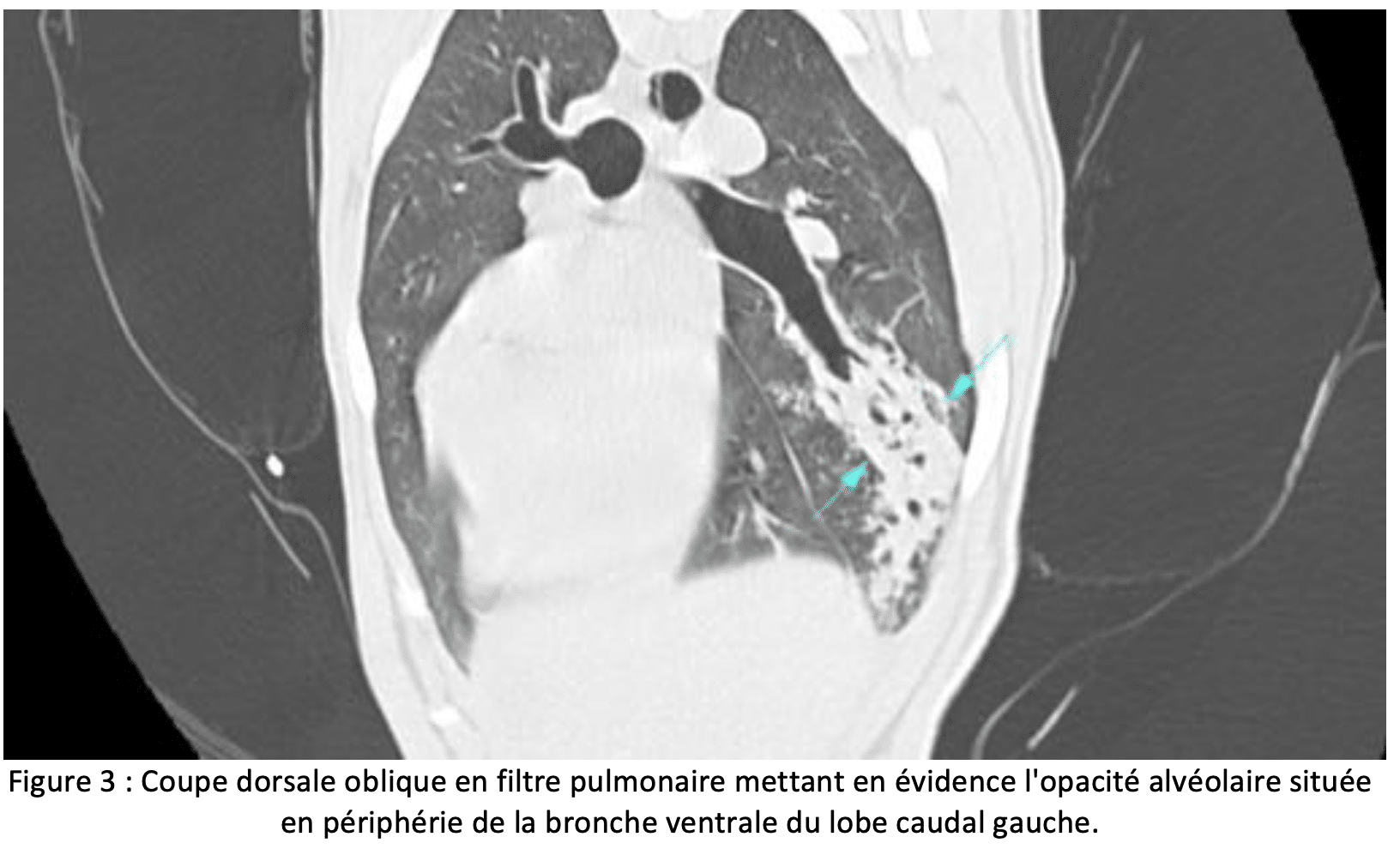
– Scanner thoracique
L’examen tomodensitométrique montre des opacifications interstitielles à alvéolaires, un épaississement pleural, des nœuds lymphatiques thoraciques de taille augmentée, un pneumothorax et/ou un épanchement pleural [7]. Le corps étranger peut être visualisé directement dans environ 20% des cas [5]. Lorsqu’il ne l’est pas, des lésions secondaires qui permettent de le localiser sont notées dans 96% des cas [5, 7].
Le scanner présente donc un intérêt certain, puisqu’il permet de localiser plus précisément le corps étranger, de manière directe, ou indirecte en repérant les lésions associées dans une très grande majorité des cas [7]. Cet examen est également intéressant car plusieurs corps étrangers peuvent être présents au sein du parenchyme pulmonaire.

– Lavage broncho-alvéolaire
Les résultats des lavages broncho-alvéolaires sont variés et dépendent du site de lavage [3]. Il est donc primordial que les analyses cyto-bactériologiques soient fibro-guidées et réalisées au moment du rinçage par bronchoscopie de la bronche dans laquelle se trouve le corps étranger.
D’après la littérature, de nombreuses espèces bactériennes peuvent être en cause : des aérobies dans 72% des cas, des anaérobies dans 48% et des mycoplasmes dans 13%. Plusieurs espèces bactériennes ont pu être isolées malgré une antibiothérapie déjà en cours [3]. Il convient donc de demander systématiquement un examen bactériologique aérobie, anaérobie et une recherche de mycoplasmes, même si l’animal reçoit déjà un traitement antibiotique, comme réalisé ici.
De même, la cytologie doit être systématiquement réalisée, puisque des cultures positives sont parfois issues de lavages broncho-alvéolaires d’animaux sains. Une cytologie permet de confirmer l’inflammation et la présence de bactéries intracellulaires [6]. Un examen bactériologique positif doit toujours être interprétée à la lumière de la clinique, des lésions et des résultats cytologiques.
– Intérêt de la fibroscopie
Selon la localisation du corps étranger, le retrait par bronchoscopie associé à une antibiothérapie, peuvent représenter une méthode thérapeutique non-invasive. En cas d’échec de cette procédure, ou lors de pneumothorax ou pyothorax, une intervention chirurgicale est souvent nécessaire [3]. Chez le chien, la bronchoscopie est la plupart du temps fructueuse avec un taux de réussite de 86% [3]. Les échecs résultent souvent d’une trop grande quantité de sang ou de mucus cachant le corps étranger et/ou (dans de rares cas) d’une localisation trop distale [3]. Il semble de plus que le poids et la taille du chien n’aient pas d’influence sur l’issue de la procédure, les chiens de petite taille n’étant pas pénalisés [3]. L’aspect de la muqueuse bronchique dépend de la durée d’évolution de l’affection. Lorsque le corps étranger est retiré rapidement après inhalation, la muqueuse peut être érythémateuse mais du mucus est rarement présent. Lorsque la toux évolue depuis un certain temps, la muqueuse peut apparaître très modifiée et du mucus (voire du pus) cache souvent partiellement ou totalement le corps étranger [1]. Toutefois, la durée d’évolution des signes cliniques n’influence pas le succès de la bronchoscopie d’après la littérature [3]. La bronchoscopie vient compléter le diagnostic tomodensitométrique, et c’est pourquoi elle doit toujours être réalisée dans l’ensemble de l’arbre respiratoire afin de s’assurer de l’absence d’autres anomalies. Elle peut ainsi permettre de déceler un second corps étranger qui serait passé inaperçu aux radiographies ou au scanner [5, 7].
Les chats peuvent aussi être atteints de corps étrangers bronchiques qui nécessitent une prise en charge adaptée (encadré 2).
Focus sur les Corps étrangers bronchiques chez le chat
La bronchoscopie présente un taux de succès moindre chez le chat (40%). Les corps étrangers sont souvent localisés dans la trachée ou la carina et sont alors accessibles avec un bronchoscope [6]. Cette localisation est expliquée par une étroitesse plus marquée du diamètre des bronches, même en comparaison avec un chien de la même taille. Les cas chirurgicaux concernent les corps étrangers logés dans les bronches inaccessibles avec des instruments de bronchoscopie [3].
Conclusion
Les corps étrangers bronchiques sont fréquents chez le chien. Cette affection doit être suspectée chez un chien de chasse présentant une toux forte et émétisante d’apparition aiguë. La réalisation de radiographies thoraciques est indispensable mais leur interprétation reste délicate. Un scanner est l’examen de choix pour visualiser directement ou indirectement le(s) corps étranger(s). Une bronchoscopie est ensuite indiquée pour explorer l’ensemble de l’arbre respiratoire et retirer le corps étranger. Cette technique est peu invasive et présente les meilleurs résultats à long terme. La nécessité de réintervenir après retrait du(es) corps étranger(s) (lobectomie sur granulome ou consolidation lobaire par exemple), n’est pas décrite dans la littérature. Il convient toutefois de suivre l’animal de façon étroite après retrait par bronchoscopie afin de s’assurer de l’amélioration clinique et radiographique.
Causes de toux d‘origine bronchique. D’après [2].
| Etiologie | Affection profonde |
| Inflammatoire | Bronchite Bronchopneumonie |
| Allergique | Asthme avec bronchospasme (chat)Bronchopneumopathie éosinophilique |
| Dégénérative | BronchomalacieBronchiectasie |
| Traumatique | Noyade Corps étranger inhalé |
| Cardio-vasculaire | Cardiomégalie avec compression d’une bronche soucheEmbolie pulmonaire |
| Néoplasique | Tumeur pulmonaire ou médiastinale |
| Infection parasitaire | Migration de nématodes intestinauxDirofilaria immitisAngiostrongylus vasorum (chien)Aelurostrongylus abstrusus (chat)Autres nématodes pulmonairesInfections fongiques |
Références
- Cerquetella M, Laus F, Paggi E et coll. Bronchial Vegetal Foreign Bodies in the Dog – Localization in 47 Cases. J. Vet. Med. Sci. 2013;75(7):959–962 c
- Ferasin L. Coughing In : Côté E, Ettinger SJ, Feldman EC, éditeurs. Textbook of veterinary internal medicine : diseases of dog and cat. 8th ed. Elsevier, St Louis, Missouri. 2017:503-509
- Hunt GB, Johnson LR, Tenwolde AC et coll. The Role of Bronchoscopy in Foreign Body Removal in Dogs and Cats: 37 Cases (2000 –2008). J Vet Intern Med. 2010;24:1063–1068
- Johnson V, Mantis P, Morandi F. The bronchial tree. In : Johnson V, Schwarz T, éditeurs. BSAVA Manual of Canine and feline Thoracic Imaging. BSAVA. 2008:228-241
- Lamb CR, Lee KCL, Vansteenkistee DP. Computed tomographic findings in 44 dogs and 10 cats with grass seed foreign bodies. J Small Anim Pract. 2014;55:579–584
- Mahonyy O, Yeun Rha J. Bronchoscopy in Small Animal Medicine: Indications, Instrumentation, and Techniques. Clin Tech Small Anim Pract. 1999;14(4):207-212
- Schultz RM, Zwingenberger A. Radiographic, Computed Tomographic, and Ultrasonographic Findings with Migrating Intrathoracic Grass Awns in Dogs and Cats, Vet Radiol Ultrasound. 2008;49(3):249–255